【文献解读】David Liu 团队 Nature 新作:基因编辑如何让细胞“忽略错误”?
![]()
今年11月19日,基因编辑领域又迎来一项备受关注的突破。David Liu 团队在Nature发表最新研究,提出了一个新的基因编辑策略——PERT(Prime Editing-mediated Readthrough of Premature Termination Codons),为由无义突变引起的多种遗传病提供了一种可能的“统一治疗”方法。

原文链接:https://www.nature.com/articles/s41586-025-09732-2
在传统基因治疗模式中,每种突变通常需要设计一套独立的编辑方案。这不仅成本高、周期长,也让罕见病患者难以受益。PERT 的目标就是打破这一限制。
01
无义突变及其挑战
无义突变(Nonsense Mutation)会把本应编码氨基酸的密码子变成终止密码子,从而导致蛋白质“提前结束”。这一类突变占ClinVar数据库(NCBI收录已知致病基因变异及其科学证据的数据库)所有致病突变的约 24%,但散布在许多不同基因中,因此难以用一种工具统一解决。
02
PERT的核心原理
要理解 PERT,先从细胞“造蛋白”的方式说起:mRNA 就像蛋白质的“说明书”,而 tRNA 是搬运氨基酸的小帮手,把说明书上的指令变成完整蛋白。说明书里有三个特定的“停止信号”——UAA、UAG 和 UGA,当 tRNA 读到这些密码子时,蛋白就停止合成。无义突变的问题在于这些停止信号出现在说明书中间,导致蛋白质提前“收工”,无法正常发挥作用。
研究团队设计出一种“抑制性 tRNA”,当遇到错误的终止信号时,它不会停下来,而是继续加上一个氨基酸,让蛋白质顺利延续下去。随后,利用 prime editing 将这种 tRNA 稳定地植入细胞基因组,使细胞长期表达这种“会忽略错误”的 tRNA。
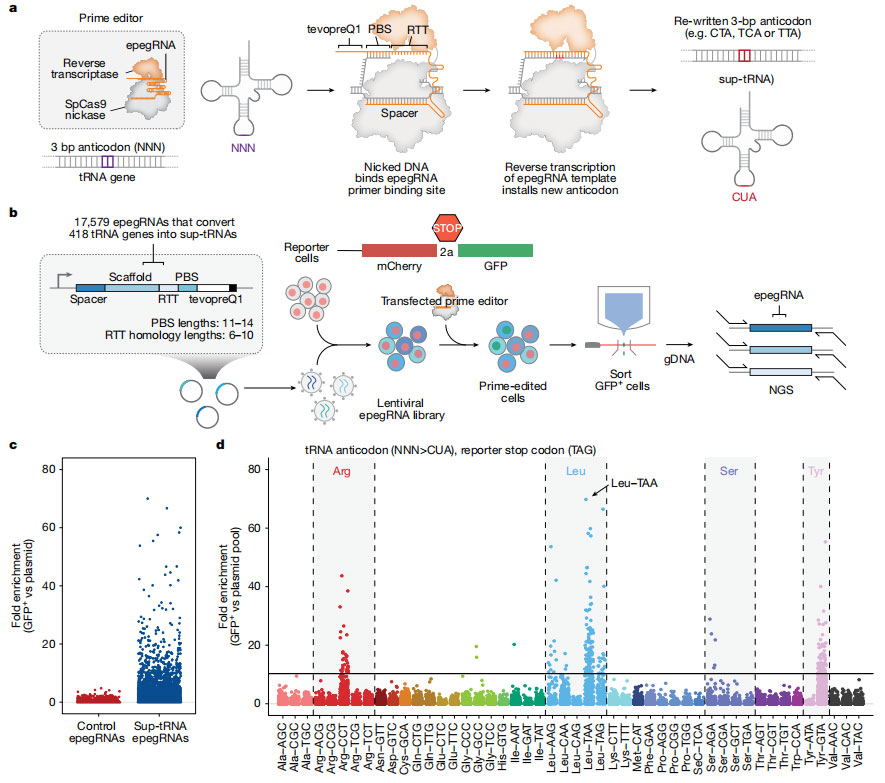
图1 Prime editing将内源性tRNAs转换为抑制性tRNAs(sup-tRNAs)的策略
PERT的核心想法并不是“修复突变”,而是让细胞在遇到无义突变时能够继续正常合成蛋白质。既然各个疾病的共同问题是“错误终止信号”,那就直接让细胞忽略这个错误。
03
为什么 PERT 可以跨多种疾病?
虽然不同疾病涉及的基因各不相同,但它们有一个共同问题:都出现了无义突变,也就是蛋白质合成被提前中断。PERT 正是针对这个“共性问题”,所以理论上,只要是这种类型的突变,都可以用同一种方法处理,让蛋白质顺利合成。
为了寻找最优 sup-tRNA 变体,研究团队对 tRNA 基因进行饱和突变,评估多种可被 Prime Editing 访问的变异组合。通过构建不同抗反应区域突变组合,团队筛选出多种具有高 readthrough 效率的工程化 sup-tRNA,蛋白产量相对野生型可达 35%以上,为不同无义突变提供基础工具。
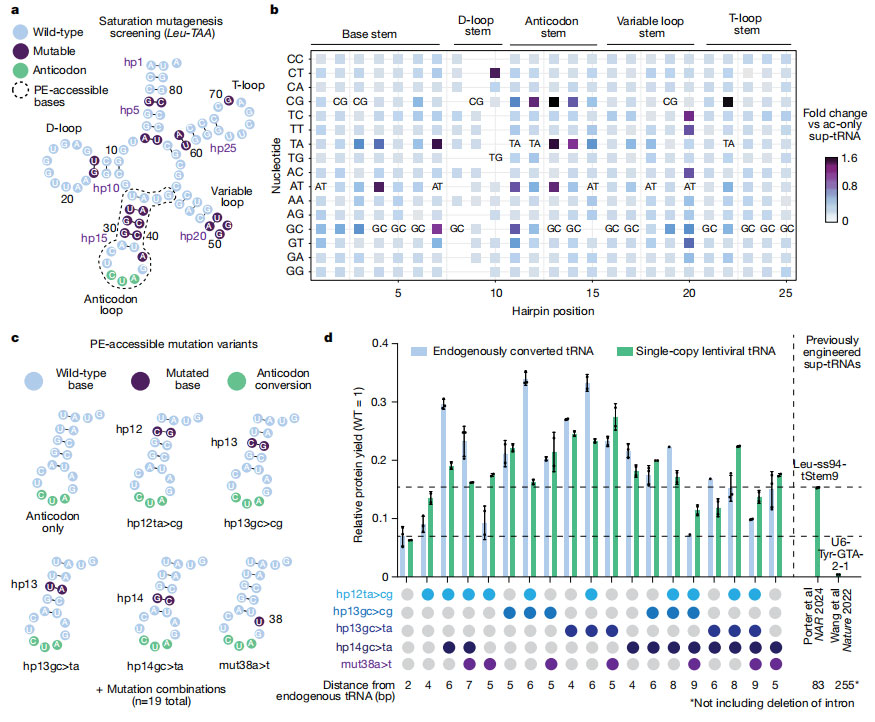
图2 确定可通过 prime editing 实现的 sup-tRNA 突变组合
04
PERT 的优化与细胞验证
为了进一步优化 Prime Editing 系统,研究团队设计了多种 Prime Editors和 epegRNA 架构,并在不同 PBS(primer binding site,起始结合区)和 RTT(reverse transcription template,逆转录模板)长度组合下测试了编辑效率,同时评估了 MLH1dn(MutL homolog 1 dominant negative,DNA 修复抑制蛋白)存在与否对编辑结果的影响。通过这种系统化优化实现高效的 sup-tRNA 安装,为后续在疾病模型中的功能验证奠定了基础。
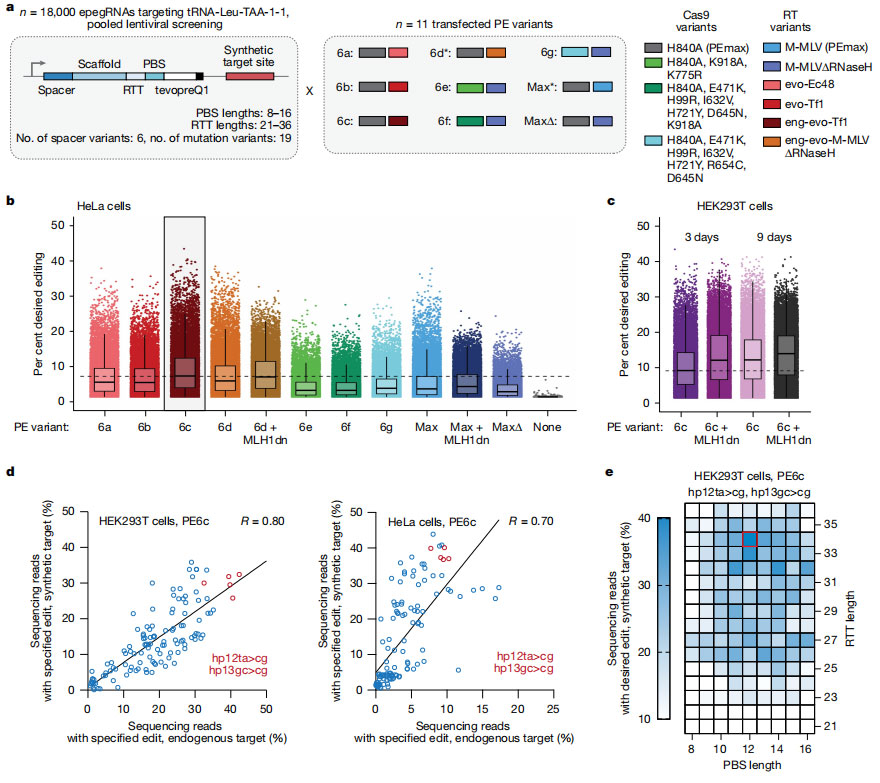
图3 工程化 sup-tRNA 安装的 prime editing 策略优化
为了检验 PERT 的实际效果,研究团队在几种由无义突变引起的遗传病细胞模型中进行了测试,其中包括 Batten 病、Tay-Sachs 病和 Niemann-Pick C1 型病。在六个 HEK293T 疾病模型中安装工程化 sup-tRNA 后,编辑效率达到 56–84%,最终能够恢复 TPP1、HEXA、NPC1 蛋白或酶活,并达到甚至有超过已知的治疗阈值。
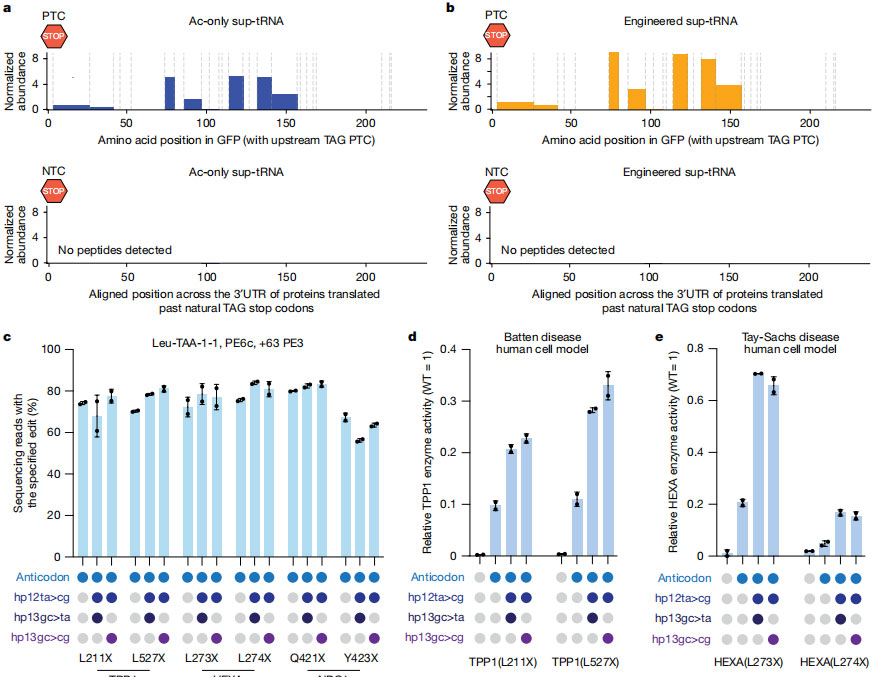
图4 Prime Editing 安装的 sup-tRNA 可在多种疾病背景下恢复蛋白表达
05
PERT 的动物模型验证
在 in vivo 实验中,团队使用 AAV9将 Prime Editing 系统和 sup-tRNA 引入新生小鼠脑内。通过 GFP 报告系统评估 readthrough 效率,接受编辑的细胞中 GFP 蛋白相对产量达到 24%–26%,证明安装的 sup-tRNA 在动物体内可以生成功能性蛋白。
随后,在 Hurler 综合征(MPS-I,小鼠 IduaW392X 模型)实验中,PERT 在受损组织中恢复约 6% 的 IDUA(α-L-iduronidase,溶酶体酶)酶活,病理表现几乎消失。脑、肝、脾及心脏组织的病理分析显示,未处理小鼠的泡沫细胞累积、Purkinje 细胞空泡化及 GAG(glycosaminoglycan,糖胺聚糖)沉积在 PERT 处理组中得到明显改善或消失,表明部分蛋白功能恢复即可带来显著治疗效果。
随后,在 Hurler 综合征(MPS-I,小鼠 IduaW392X 模型)实验中,PERT 在受损组织中恢复约 6% 的 IDUA(α-L-iduronidase,溶酶体酶)酶活,病理表现几乎消失。脑、肝、脾及心脏组织的病理分析显示,未处理小鼠的泡沫细胞累积、Purkinje 细胞空泡化及 GAG(glycosaminoglycan,糖胺聚糖)沉积在 PERT 处理组中得到明显改善或消失,表明部分蛋白功能恢复即可带来显著治疗效果。
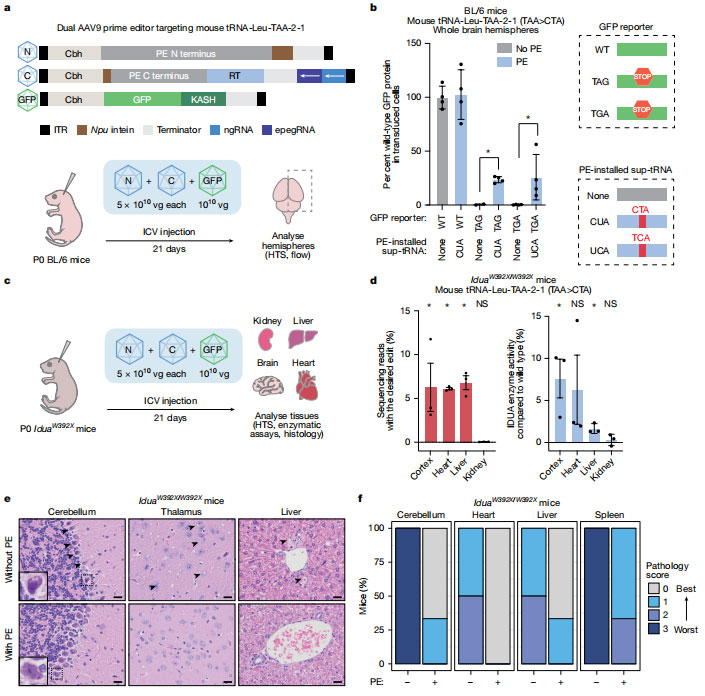
图5 Prime Editing 生成功能性 sup-tRNA,恢复动物疾病模型
总的来看,PERT 通过将内源性 tRNA 基因转化为 sup-tRNA,实现了一套编辑策略覆盖多种无义突变相关疾病,结合 prime editing 的一次性持久性,展现出跨疾病、潜在“一次治疗,多病受益”的优势。细胞和动物模型实验均显示 PERT 可恢复功能性蛋白或酶活,同时未发现明显毒性或脱靶效应,为将来临床应用奠定了基础。
未来,PERT可与组织特异性病毒或纳米颗粒载体结合,实现针对不同器官的精准治疗,或与小分子药物联合,提高 readthrough 效率,为更多遗传病患者提供新的治疗希望。
专注基因编辑十几载,艾迪基因基于先导编辑PE (Prime Editing)技术全新研发的Bingo™平台 ,结合高效sgRNA设计与严格的单克隆筛选体系,可为客户定制多种类型的点突变细胞系。
近期资讯

联系我们
18102225074(微信同号)market@edgene.cn













Comment (4)