一文让你轻松读懂CRISPR检测技术原理

01
CRISPR检测-认识CRISPR/Cas系统
为了测试化学合成的sgRNA用于基因组编辑的效用,作者对sgRNA进行三种不同的化学修饰,包含M、MS、MSP,加在5’和3’末端的三个核苷酸上,并评估其的最终效果。作者选择了三个已经被细胞系中具有高基因编辑频率的sgRNA靶向的人类基因:IL2RG,HBB,和CCR5。结果表明,通常情况下,化学修饰的sgRNA保持了高度的特异性。在靶和脱靶比率的差异表明sgRNA的化学变化具有调节活性的可能性。
为了进一步探索化学修饰的人类细胞系中的sgRNA,作者转向一个全RNA递送平台,联合递送sgRNA和编码Cas9的mRNA。并通过核转染的方式联合或连续递送Cas9和各种靶向IL2RG的合成sgRNA,探索化学修饰是否对sgRNA活性的半衰期有影响。之后,作者比较了未修饰和MS修饰的sgRNA在脱靶位点的活性。研究发现,当化学修饰的sgRNA与Cas9 mRNA共同递送或作为RNP递送时,在人类细胞系中显示出比未修饰的sgRNA更具优势的基因编辑。
为了进一步探索化学修饰的人类细胞系中的sgRNA,作者转向一个全RNA递送平台,联合递送sgRNA和编码Cas9的mRNA。并通过核转染的方式联合或连续递送Cas9和各种靶向IL2RG的合成sgRNA,探索化学修饰是否对sgRNA活性的半衰期有影响。之后,作者比较了未修饰和MS修饰的sgRNA在脱靶位点的活性。研究发现,当化学修饰的sgRNA与Cas9 mRNA共同递送或作为RNP递送时,在人类细胞系中显示出比未修饰的sgRNA更具优势的基因编辑。

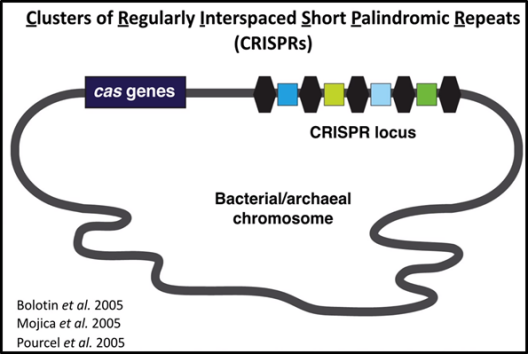
图1.CRISPR/Cas系统(图片来源于网络)
02
CRISPR/Cas系统具体是如何来抵御外来病毒入侵的呢?
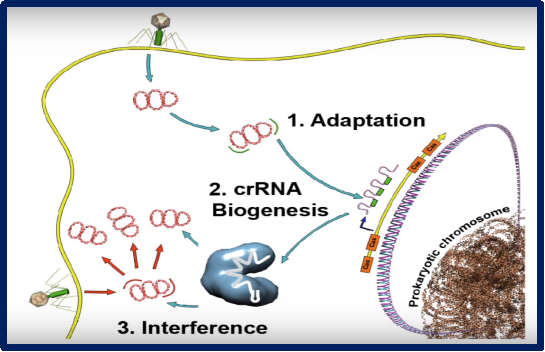
其过程主要有以下三个阶段:
1、适应阶段:将外来的病毒或噬菌体的DNA片段作为间隔序列(spacer)整合到CRISPR array;
2、表达阶段:CRISPR array被转录为初级转录产物pre-crRNA,pre-crRNA被Cas蛋白加工产生成熟的CRISPR RNA(crRNA);
3、干扰阶段:成熟的crRNA与Cas蛋白形成核糖核蛋白复合体,crRNA引导Cas蛋白特异性靶向切割入侵者的核酸,达到免疫防御的目的。
1、适应阶段:将外来的病毒或噬菌体的DNA片段作为间隔序列(spacer)整合到CRISPR array;
2、表达阶段:CRISPR array被转录为初级转录产物pre-crRNA,pre-crRNA被Cas蛋白加工产生成熟的CRISPR RNA(crRNA);
3、干扰阶段:成熟的crRNA与Cas蛋白形成核糖核蛋白复合体,crRNA引导Cas蛋白特异性靶向切割入侵者的核酸,达到免疫防御的目的。

图2.CRISPR-Cas免疫涉及三个不同的机制阶段(图片来源于网络)
知道了CRISPR/Cas的来源及在细菌免疫系统中发挥的作用,人们开始将此免疫系统应用在基因编辑上,那么我们再一起看一下CRISPR/Cas系统是如何应用到CRISPR检测的呢?
03
CRISPR检测原理
CRISPR检测技术所用的Cas蛋白主要有Cas12、Cas13和Cas14,与Cas9不同的是,Cas12、Cas13和Cas14除了具有特异性切割靶序列的功能外,在切割靶标序列之后,还具有非特异性切割其它核酸序列的功能(即Cas蛋白的反式切割活性)。在反式切割激活的状态下,可非特异性切割任意单链,将体系中的荧光标记探针切碎,即可用来检测信号。由此开展各种基因检测技术。
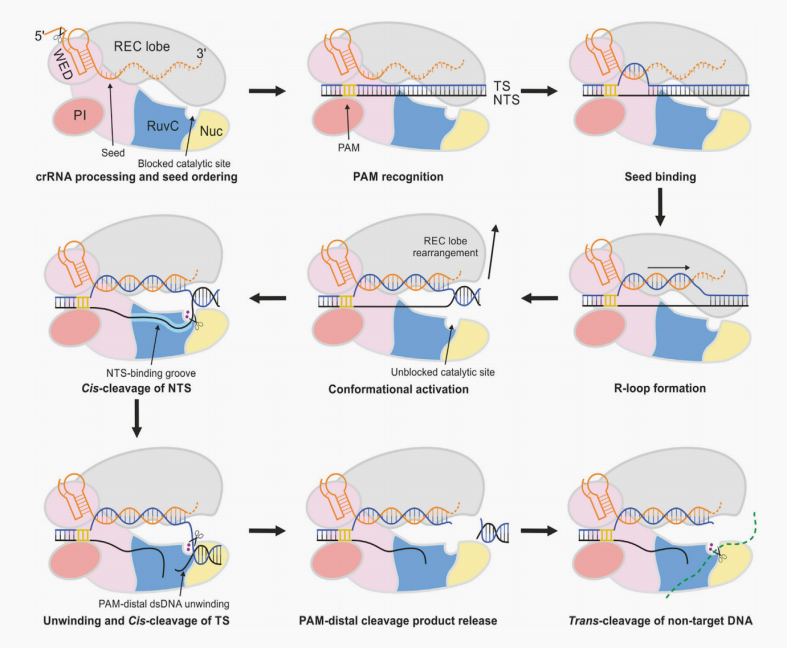
以Cas12a为例:Cas蛋白反式切割活性激活过程
Cas12a处理其自身的crRNA5’端,dsDNA靶标识别始于WED和PI结构域的PAM识别,从而促进dsDNA靶标的展开。
r-环的形成是由TS结合crRNA片段而启动的。过程的crRNA-TS配对,同时TS-NTS展开导致形成完整的r-环。crRNA-TS DNA氢化诱导REC叶的构象变化,导致RuvC结构域的催化位点的变构解封。NTS结合槽引导移位的NTS向RuvC催化位点移动,导致NTS的顺式裂解。
随后,进一步解开pam-远端TS-NTS双链,使TS进入RuvC催化位点,导致TS的顺式裂解。pam-远端dsDNA被释放,而PAM-近端dsDNA仍然与Cas12a-crRNA复合物结合。这使得Cas12a保持在一个催化激活的构象中,这允许非靶标ssDNA的反式裂解。
主要概括为以下四个步骤:
1、Cas12a蛋白的WED和PI结构域识别dsDNA靶标的PAM序列,从而促进dsDNA靶标的展开。
2、crRNA和靶标链互补配对,和非靶标链行成R-loop环。
3、REC远离RuvC,RuvC结构域切割位点暴露,顺式切割非靶标链和靶标链。
4、PAM远端dsDNA被释放,Cas12a-crRNA复合物与近端dsDNA结合,Cas12a反式裂解被激活。
以Cas12a为例:Cas蛋白反式切割活性激活过程
Cas12a处理其自身的crRNA5’端,dsDNA靶标识别始于WED和PI结构域的PAM识别,从而促进dsDNA靶标的展开。
r-环的形成是由TS结合crRNA片段而启动的。过程的crRNA-TS配对,同时TS-NTS展开导致形成完整的r-环。crRNA-TS DNA氢化诱导REC叶的构象变化,导致RuvC结构域的催化位点的变构解封。NTS结合槽引导移位的NTS向RuvC催化位点移动,导致NTS的顺式裂解。
随后,进一步解开pam-远端TS-NTS双链,使TS进入RuvC催化位点,导致TS的顺式裂解。pam-远端dsDNA被释放,而PAM-近端dsDNA仍然与Cas12a-crRNA复合物结合。这使得Cas12a保持在一个催化激活的构象中,这允许非靶标ssDNA的反式裂解。
主要概括为以下四个步骤:
1、Cas12a蛋白的WED和PI结构域识别dsDNA靶标的PAM序列,从而促进dsDNA靶标的展开。
2、crRNA和靶标链互补配对,和非靶标链行成R-loop环。
3、REC远离RuvC,RuvC结构域切割位点暴露,顺式切割非靶标链和靶标链。
4、PAM远端dsDNA被释放,Cas12a-crRNA复合物与近端dsDNA结合,Cas12a反式裂解被激活。

图3 Cas12a介导的DNA顺式和反式裂解模型图(图片来源于网络)
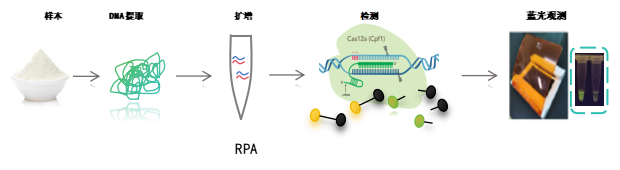
一句话概括来说CRISPR检测就是由靶标核酸激活Cas蛋白的反式切割活性,将体系中的荧光标记探针切碎,发出荧光信号,完成靶标核酸检测的过程。

(图片来源于网络)
艾迪基因专注于CRISPR技术,提供一系列高质量的基因编辑服务和体外诊断产品:CRISPR文库筛选、细胞基因编辑、单克隆筛选、CRISPR检测。致力于为CRISPR相关、基因功能研究相关、体外诊断以及治疗相关的科学研究提供最高效的技术服务。

联系我们
18102225074(微信同号)market@edgene.cn















Comment (4)