一窥基因编辑“顶流”的秘密:Cas9蛋白的双叶结构解析

“物质基础决定上层建筑”,在生命体系中同样适用。
01
Cas9蛋白的双叶结构
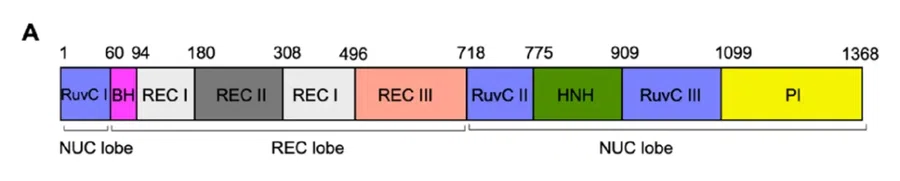
Cas9的结构可以分为两大部分,或者称为两个“叶”(Lobe),包括识别(Recognition,REC)叶和核酸酶(Nuclease,NUC)叶。
REC叶由三个α-螺旋识别结构域(REC I,REC II,Rec III)组成,能感知并验证sgRNA或crRNA与靶DNA的配对是否正确。REC叶结构独特,与其他已知蛋白没有相似性或同源性。
NUC叶则包含保守的NHN结构域和被分割为三部分的RuvC-like结构域(RuvC I,RuvC II,RuvC III)。
l 以spCas9一级结构(图A)为例,RuvC I区域位于肽链的N端,并通过一段富含精氨酸的桥螺旋(Bridge Helix,BH)与REC叶连接;
l REC叶的C端紧邻着RuvC II,随后是NHN结构域以及被其隔开的RuvC III;
l 从RuvC III延伸出来的PAM相互作用域(PAM Interacting,PI)则位于整个Cas9蛋白的最C端。
02
Apo-Cas9的构象特征
基因编辑的实现依靠Cas9与sgRNA形成的复合体。
基于冷冻电镜技术的观察结果,在未结合 sgRNA 与靶 DNA 的 Apo 状态下,Cas9的REC叶与NUC叶相对闭合,二者之间容纳核酸的沟槽尚未完全打开。REC叶三个子结构域处于非活性排列,桥螺旋也保持相对平直的构象,二者富含正电荷的表面均未暴露或未成形,无法与带负电荷的DNA互相作用。
03
Apo状态下REC叶的调控功能
然而近来的研究表明,Apo-Cas9并非全无功能。
04
结语
无论是作为基因编辑工具,抑或是作为细菌免疫系统的研究对象,Cas9蛋白都备受研究人员关注,是生命科学领域里当之无愧的“C位”。
参考文献
1. Zhou, Xufei et al. “Cas9 senses CRISPR RNA abundance to regulate CRISPR spacer acquisition.” Nature vol. 647,8091 (2025): 1054-1062. doi:10.1038/s41586-025-09577-9
2. Babu, Kesavan et al. “Coordinated Actions of Cas9 HNH and RuvC Nuclease Domains Are Regulated by the Bridge Helix and the Target DNA Sequence.” Biochemistry vol. 60,49 (2021): 3783-3800. doi:10.1021/acs.biochem.1c00354

2. Babu, Kesavan et al. “Coordinated Actions of Cas9 HNH and RuvC Nuclease Domains Are Regulated by the Bridge Helix and the Target DNA Sequence.” Biochemistry vol. 60,49 (2021): 3783-3800. doi:10.1021/acs.biochem.1c00354

联系我们
18102225074(微信同号)market@edgene.cn















